АЛКАНЫ - углеводороды, в молекулах которых атомы связаны одинарными связями.
Формула алканов:
CₓH₂ₓ₊₂
В молекулах алканов атомы углерода находятся в состоянии
sp³ гибридизации (т.е. все связи одинарные).
Атомы углерода образуют только
σ-связи друг с другом и атомами водорода.
CH₄ - метан
С₂H₆ - этан
С₃Н₈ - пропан
С₄Н₁₀ - бутан
С₅H₁₂ - пентан
С₆Н₁₄ - гексан
С₇Н₁₆ - гептан
С₈Н₁₈ - октан
С₉Н₂₀ - нонан
С₁₀Н₂₂ - декан (все эти названия веществ стоит выучить, они составляют элементарную основу органической химии)
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Углеводороды от CH₄ до С₄Н₁₀ - газы
Углеводороды от С₅Н₁₂ до С₁₅Н₃₂ - жидкости
Все остальные углеводороды - твердые вещества
Самый простейший углеводород -
метан - природный газ без цвета, вкуса и запаха. Именно его мы используем в бытовых и промышленных газовых приборах (запах "газа" на самом деле является запахом меркаптанов - серусодержащих соединений, специально добавляемых к метану, для того чтобы люди, находящиеся рядом с ними, могли определить утечку по запаху).
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
1. р. замещения (самая главная для алканов)
галогенирование - протекает ступенчато по радикальному механизму. (катализатором данной реакции является свет, пишется над стрелкой как hν)
СH₄ + Cl₂ → CH₃Cl + HCl (хлорметан)
CH₃Cl + Cl₂ → CH₂Cl₂ + HCl (дихлорметан)
CH₂Cl₂ + Cl₂ → CHCl₃ + HCl (трихлорметан)
CHCl₃ + Cl₂ → CCl₄ + HCl (тетрахлорметан)
реакция действует по правилу Зайцева: в р. замещения водород замещается у атомов, где водорода меньше, например:
CH₃-CH₂-CH₃ + Br₂ → CH₃-CH-CH₃ + HBr (2-бромпропан)
|
Br
2. дегидрирование - отщепление водорода
CH₃-CH₃ → CH₂=CH₂ + H₂ (получается этилен, катализаторами данной реакции будет температура и Ni)
3. пиролиз - разложение низкомолекулярных алканов (от CH₄ до C₃H₈)
2CH₄ → CH≡CH + 3H₂ ( пиролиз метана - основной способ получения ацетилена в промышленности, при температуре 1500°С)
крекинг - разложение высокомолекулярных алканов (реакция протекает при высокой температуре)
C₁₅H₃₂ → C₇H₁₆ + C₈H₁₆ (в реакции получается алкан и алкен)
C₇H₁₆ → C₄H₁₀ + C₃H₆
C₄H₁₀ → C₂H₆ + C₂H₄
4. изомеризация (катализаторами реакции будет температура и AlCl₃)
CH₃-CH₂-CH₂-CH₂-CH₃ = CH₃-CH-CH₂-CH₃
|
CH₃
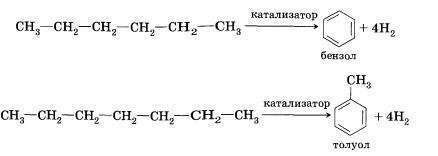
5. ароматизация (от C₆H₁₄)
см. вложение
ПОЛУЧЕНИЕ АЛКАНОВ
1. сплавление солей карбоновых кислот со щелочами (при температуре)
CH₃-СН₂-COONa + NaOH → CH₃-СН₃↑ + Na₂CO₃
2. метан получают гидролизом карбида алюминия
Al₄C₃ + 12H₂O → 3CH₄↑ + 4Al(OH)₃
3. р. Вюрца - сплавление галогенпроизводных алканов с металлическим натрием, приводит к удлинению цепи атомов углерода
C₂H₅Br + CH₃Br + 2Na → 2NaBr + C₃H₈
2CH₃-CH-CH₃ + CH₃-Cl + 2Na → 2NaCl + CH₃-CH-CH₃
| |
CH₃ CH₃