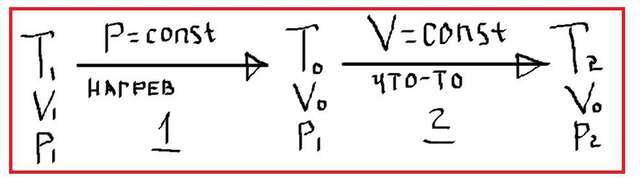
1) досконально изучаем задачу, вникаем в каждое слово, делаем схему (смотрите приложение)
2) раз дано количество теплоты, то целесообразно отталкиваться именно от него, а потом смотреть, что неизвестно и что с этим можно сделать
по 1 закону термодинамики: Q = A + ΔU
A = A1 + A2
• при изобарном процессе работа в общем случае всегда считается по формуле: A = P ΔV
для нашего случая имеем: А1 = P1 (V0 - V1)
• во втором случае, когда объем постоянен, работы не совершается (это видно из верхней формулы)
ΔU = ΔU1 + ΔU2
• в общем случае формула внутренней энергии газа такова по определению: U = N Ek (сумма кинетических энергий всех молекул; так как газ идеальный, энергией взаимодействия молекул (потенциальной) пренебрегаем). из нее можно получить следующее: U = (i/2) * v R T, где i - число степеней свободы. для одноатомного газа i = 3, для двухатомного газа i = 5
итак, получаем: ΔU1 = 1.5 v R (T0 - T1)
ΔU2 = 1.5 v R (T2 - T0)
для простоты расчетов в дальнейшем важно заметить, что значение 1.5 v R (T0 - T1) соответствует значению 1.5 P1 (V0 - V1) согласно закону Менделеева-Клапейрона
таким образом, получаем:
Q = 2.5 P1 (V0 - V1) + 1.5 v R (T2 - T0).
3) заметим, что в уравнении 1 закона термодинамики у нас 4 неизвестных, и если с двумя мы знаем, что делать, то P1 и T0 нужно как-то выразить
кстати, сразу введем параметр: x = V0 / V1 (именно это отношение нас и просят найти)
• температуру T0 можно выразить из газового закона Гей-Люссака (он применим для газа данной массы, с которым что-то делают при постоянном давлении):
V1/T1 = V0/T0,
T0 = (T2 V0)/V1 = T1 x
• давление P1 можно выразить из газового закона Шарля (но это долго, ибо нужны будут дополнительные действия), а можно из закона Менделеева-Клапейрона. получаем:
P1 = (v R T1)/V1.
4) задача почти решена, осталось подставить все найденные выражения в 1 закон термодинамики
дабы не утомлять вас многочисленными строками матана, предоставлю вам конечную формулу. к тому же, матан здесь нетрудный
x = (Q/(vRT1)) + 2.5 - 1.5 (T2/T1).
находим, что x ≈ 2.105